morfologi
På en makroskopisk nivå kan en variabel grad av kortikal atrofi (reduktion av vävnad eller organmassa) observeras i Alzheimers sjukdom, kännetecknad av utvidgningen av parietalfurarna, mer accentuerade i de främre, temporala och parietala lobarna. Denna atrofi kompenseras av en utvidgning av ventrikulära håligheter sekundär förlusten av parenchyma (figur 1). I synnerhet i sjukdomens avancerade stadier, strukturerna av den mediala temporala loben, inklusive hippocampus, entorhinal cortex och amygdala, atrofi allvarligt, med tanke på deras engagemang från början av patologin.
Vidare presenterar Alzheimers sjukdom även mikroskopiska förändringar, kända som extracellulära senila plack och intracellulära neurofibrillära kluster, vilka utgör grunden för histologisk diagnos. Med sjukdomsprogressionen finns det en allvarlig neuronförlust åtföljd av glios (omskriven eller diffus proliferation, reaktiv i naturen, av neurogliaceller, det vill säga celler som utgör stödstrommen av nervvävnad) i samma regioner där närvaron av neurofibrillära plack och kluster är större.
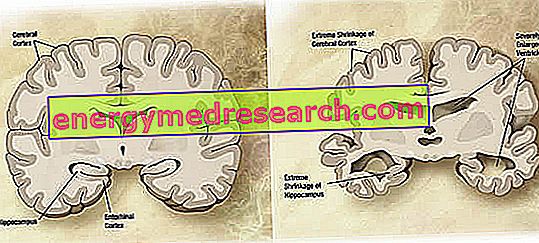
Figur 1. Koronavsnitt i hjärnan: Skillnader mellan normal hjärna och hjärna som påverkas av AD (wikipedia bildkälla).
patogenes
Alzheimers sjukdom karakteriseras huvudsakligen av två typiska skador: den extracellulära ackumuleringen av senila plack som huvudsakligen består av β-amyloidpeptid (Aβ) och intraneuronala neurofibrillära kluster, bildade av hyperfosforylerat tau-protein.
- Senile plack kan hittas i nivå med hjärnområden, såsom hippocampus, amygdala och neocortex.
Ap-peptiden härrör från en proteolytisk kapning av amyloidproteinprekursorn (APP), med p-sekretas. Denna snitt genererar ett terminal karboxifragment av 99 rester (CTF eller C99) som därefter skärs av p-sekretas för att alstra Ap-fragment med olika längder. Det är känt att den mest rikliga arten av Ap är Ap40-fragmentet. Ett annat känt fragment bildat från den proteolytiska skuren, mindre riklig än Ap 40, är A 422, mer benägen att bilda amyloidfibriller, vilka ackumuleras som en Ap-art i hjärnan hos en individ med Alzheimers sjukdom.
- En annan komponent som är närvarande i Alzheimers sjukdom representeras av neurofibrillära kluster som består av buntar av filament närvarande i cytoplasma av neuroner. Neurofibrillära kluster är olösliga och verkar vara resistenta mot proteolysprocesser in vivo, vilket således kvarstår i vävnadssektioner även under lång tid efter neuronaldöd. Observation av strukturen består av fibrillärkluster av dubbla spiralfilament och linjära filament med liknande sammansättning. Analysera kompositionen är dubbelspiraltrådarna huvudsakligen gjorda av hyperfosforylerat tau-protein. Tau är ett axonalt protein associerat med mikrotubuli vilket underlättar dess sammansättning.
Andra viktiga neuropatologiska förändringar som finns närvarande i Alzheimers sjukdom innefattar mitokondriell dysfunktion, oxidativ neuronskada, synaptisk förlust och axonal degenerering.
Neurokemiska aspekter
Som redan förklarat, representerar Ap-peptid, som härrör från proteolytisk skurning av APP-prekursorn, en neurotoxisk komponent av Alzheimers sjukdom . Specifikt har det antagits att Aβ kan vara viktigt för normala hjärnfunktioner och om det övervinner vissa koncentrationer kan det bli neurotoxiskt. Dessutom kan både aggregatema och de olika isoformerna av Ap ha en annan biologisk, fysiologisk eller patologisk roll, bestämma och delta i de efterföljande stadierna av sjukdomen. Det har observerats att Aβ fungerar som en neuromodulator som påverkar frisättningen av vissa neurotransmittorer i frånvaro av uppenbara tecken på neurotoxicitet.
Exempelvis kan den neuromodulatoriska rollen av Aβ i ett fysiologiskt sammanhang ha en viktig betydelse för den korrekta balansen i neurotransmittorsystemet. Det är välkänt att detta system består av neurotransmittorer, ämnen som förmedlar information mellan cellerna som utgör nervsystemet, neuronerna, genom synaptisk överföring.
Vid patologiska förhållanden kan Ap-medierad synaptisk överföring vara relaterad till förändring av neurotransmission före neurodegenerativa händelser. Som ett resultat av dessa förändringar kan tidiga kognitiva och icke-kognitiva störningar uppstå, baserat på de berörda neurotransmittorsystemen och de olika hjärnområdena som är inblandade.
Ändringarna i neurotransmittorsystemen och signaltransduktionsmekanismen i hjärnorna hos individer som lider av Alzheimers sjukdom är mycket komplexa. Ett av systemen som verkar förändras avser det kolinerga signaleringssystemet, vilket innefattar neurotransmittorn acetylkolin. Det har faktiskt visat sig att individer som lider av Alzheimers sjukdom uppvisar minskad kolinerg överföring på nivån av cortex och hippocampus, viktiga hjärnområden avsedda för fenomen som lärande och minne. Förutom detta neurotransmittorsystem har förändringar i det noradrenerga, serotonerga och glutamat- och GABA-systemet observerats vid Alzheimers sjukdom.