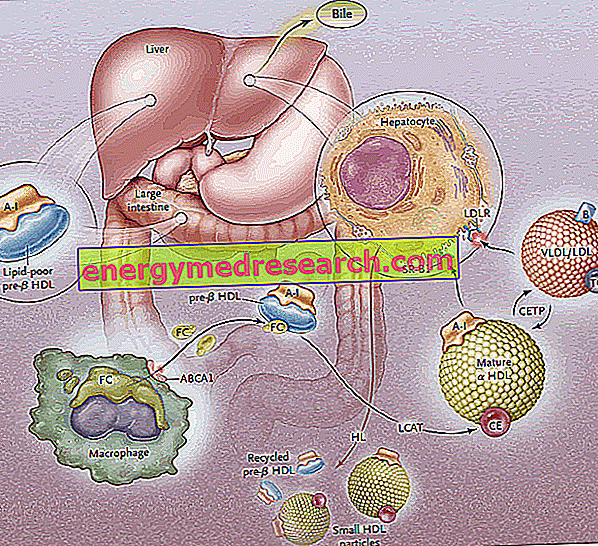
Omvänd kolesteroltransport (RCT) är den process genom vilken kolesterol avlägsnas från perifera vävnader genom inkorporering i HDL lipoproteiner och efterföljande transport till levern för gallutskiljning.
Perifera celler, som alla icke-tarm- eller leverceller, kan inte försämra överskott av kolesterol; därför är närvaron av en mekanism dedikerad till avlägsnande av kolesterol från cellerna viktigt för upprätthållandet av cellulär homeostas. Denna mekanism, som syftar till hepatisk återhämtning av överskott av perifert kolesterol, kallas "omvänd kolesteroltransport" (RCT: omvänd kolesteroltransport ).
Låt oss undersöka processen i detalj.
Biosyntesen av HDL-lipoproteiner passerar genom syntesen och inledande utsöndringen av huvudproteinkomponenterna (apoproteiner) följt av extracellulär förvärv av lipider (fosfolipider och kolesterol) som leder till montering och generation av mogna HDL-partiklar.
Den första etappen av omvänt kolesteroltransport består i att tarm och levern producerar discoidprekursorer av HDL, vilka på deras yta utsätter apoproteiner (främst ApoA-I); prekursormolekyler av HDL som kallas pre-B-HDL frigörs därmed, vilka innefattar mycket små mängder kolesterol och lipider, speciellt fosfolipider. Förekomsten av dessa prekursormolekyler vid perifer nivå främjar överföringen av överskott av fri kolesterol (FC) - fly från perifera vävnadsceller - till apo AI, genom ingrepp av en membrantransportör som kallas ATP-bindande kassett A1 (ABCA1 ). Denna transportör är belägen på cellytan och i Golgi-membranen och kan transportera lipiderna från Golgi-apparaten till cellmembranet, vilket underlättar deras utflöde. Vid denna tidpunkt ingriper ett plasmatiskt enzym av hepatiskt ursprung, så snart det fria kolesterolet kommer in i de naturliga HDL-grupperna, som kallas plasma-lecitinkolesterol-acyltransferas eller mer enkelt LCAT; detta enzym omvandlar det fria kolesterol som införlivas i pre-B-HDL till kolesterolestrar, omvandlar pre-B-HDL till sin mogna a-HDL-form; i praktiken omvandlar kontinuerlig ackumulering av kolesterol i lipoproteinkärnan discoid HDL till sfäriska och plumpa partiklar, som vidare kan förvärva apoproteiner från lipoproteinpartiklarna rik på triglycerider och smälter samman. I hela processen spelar apolipoproteinet AI en nyckelroll, vilket stimulerar både verksamheten hos ABCA1-transportören och LCATs verksamhet. Eftersom ApoAI är det mest representerade apolipoproteinet i HDL, är dess plasmakoncentration direkt relaterad till HDL-kolesterolnivåer.
OBSERVERA: Förestringsprocessen är grundläggande för att förhindra omfördelning av kolesterol från HDL till plasmamembranet; denna mekanism utnyttjar fettsyran i position två närvarande i fosfatidylkolinmolekylerna.
Den LCAT-medierade förestringsprocessen omvandlar sedan pre-B-HDL-molekylerna till deras "mogna" a-HDL sfäriska form. Dessa lipoproteiner transporteras därefter till levern, där de frisätter kolesterol, enligt två distinkta vägar.
I ett första fall ger HDL rik på förestrad kolesterol denna lipid till lipoproteiner rika på triglycerider (mycket lågdensitets- och lågdensitetslipoproteiner), som sedan upptas av levern genom specifika receptorer (LDL-R) och avlägsnas från cirkulationen. Syftet är att förmedla perifert kolesterol till levern via LDL-receptorsystemet och sedan "ladda" HDL från överskott av kolesterol till perifer nivå för att göra dem tillgängliga igen för att ta emot det från vävnaderna. tömmer sig för kolesterol, HDL: er accepterar triglycerider i utbyte och detta händer tack vare kolesterolesteröverföringsproteinet (CETP). Uppgiften för detta protein är därför att främja omfördelningen och jämvikten mellan kolesterolestrar och triglycerider mellan HDL, LDL, IDL, VLDL, chylomicron och chylomicron lipoproteiner, vilket leder som ett nettoresultat till en anrikning i HDL-triglycerider, till nackdel för kolesterolestrar och en minskning av HDL-storlek.
Den andra vägen involverar hepatiska SR-B1-receptorer för HDL rik på förestrat kolesterol, i frånvaro av samtidig samtidig nedbrytning av proteindelen av HDL, som sedan återvinns. I praktiken tillåter detta enzym att tömma HDL från deras innehåll och regenerera nya pre-B-HDL. En del av HDL och ApoA-I emellertid internaliseras och försämras vid lysosomal nivå, både i lever- och njurcellerna. Upptaget medierat av SR-B1 görs mer effektivt genom aktiviteten av hepatlipaset, som är kapabelt att remodellera HDL genom att hydrolysera ytfosfolipiderna och tillåta flödet av förestrad kolesterol från lipoproteinkärnan mot plasmamembranet (det är hypoteserat mellan andra, att ApoE också är involverad i selektiv upptagning, eftersom möss som är deficienta för ApoE-genen visar en minskning av effekten av denna vägen). SR-BI uttrycks främst i lever, binjurar och äggstockar.