Peptidbindningen är en kovalent bindning som är etablerad mellan två molekyler, när karboxylgruppen av en reagerar med aminogruppen i den andra genom en kondensationsreaktion (eller dehydrering som leder till att en vattenmolekyl elimineras ).
Vanligtvis bildas peptidbindningen mellan två aminosyror, som härrör från en dipeptid.
Eftersom en dipeptid i sin molekyl fortfarande innefattar en aminogrupp och en karboxylsyra kan den bilda en peptidbindning med en tredje aminosyra som härrör från en tripeptid och så vidare. När antalet aminosyror är relativt litet kallas det oligopeptid, medan om antalet aminosyror ökar kallas det polypeptid eller protein.
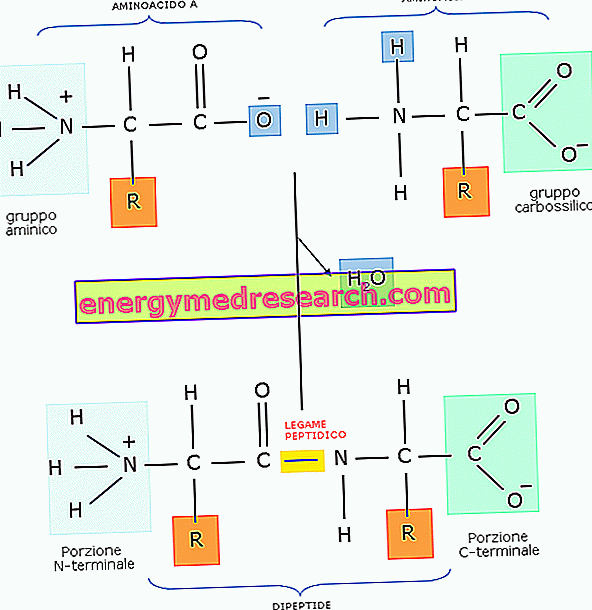
I realiteten är peptidbindningen, trots figuren, inte enkel, men presenterar för 60% en enkelbindande natur och för 40% en dubbelbindnings-natur.
I levande organismer katalyseras bildandet av peptidbindningen genom ett enzym-kallat peptidyltransferas - närvarande i den huvudsakliga subenheten av ribosomer.
Även de proteiner som införs i kosten består av kedjor av aminosyror förenade med peptidbindningar. Under matsmältningen bryts dessa bindningar av specifika enzymer (peptidaser) som finns i mag- och bukspottsköret. De enda aminosyrorna, som en gång absorberas av tarmarna, passerar från blodet och tas upp av cellerna - framför allt av de hepatiska - som förenar dem genom nya peptidbindningar för att bilda proteinerna de behöver (inte bara strukturella utan även hormonella, enzymatiska etc. .). I naturen finns det faktiskt ett stort antal proteiner med olika fysikalisk-kemiska egenskaper som härrör från de olika egenskaperna hos de 20 vanliga aminosyrorna och från hur dessa kombineras i polypeptidkedjan. Det är tillräckligt att säga att ett protein med 100 aminosyror, därmed relativt små, kan bestå av 20100 = 1, 27 x 10130 möjliga polypeptidkedjor. Anvisningarna för att bygga den korrekta aminosyrakedjan är inneslutna i individens genom.