Trypsin och chymotrypsin är två viktiga enzymer vid uppslutning av kostproteiner. Båda produceras och utsöndras som zymogener, dvs i en inaktiv form, av bukspottkörteln; Zymogenprekursorn av trypsin kallas trypsinogen, medan den hos chymotrypsin kallas chymotrypsinogen.
Trypsin och chymotrypsin tillhör den stora familjen proteolytiska enzymer (involverade i proteinförtunning) och till endopeptidas-undergruppen. Dessa substanser - inklusive gastric pepsin och pankreaselastas - attackerar peptidbindningar i aminosyrakedjan, vilket ger upphov till mindre molekylära fragment. De enzymer som tillhör den andra gruppen, exopeptidaser, fullbordar trypsin och chymotrypsins arbete, avlägsnar individuella aminosyror från ändarna av peptidkedjan; Bukspottkörtelkarboxipeptidaser (A1, A2 och B, som attackerar karboxyländen) tillhör denna familj, men också aminopeptidaser (som anfaller den aminoterminala änden) och dipeptidaser, både producerade och utsöndrade av tarmarnas slemhinnor. Vissa karboxipeptidaser, liknande de som ses för trypsin (trypsinogen) och chymotrypsin (chymotrypsinogen) utsöndras av bukspottkörteln i en inaktiv form. I samtliga tre fall är enzymet involverat i den enzymatiska aktiveringsprocessen enteropeptidaset, ett protein som produceras och utsöndras av cellerna i duodenalslimhinnan; mer specifikt är enteropeptidas specifik för trypsinogen, vilken en gång omvandlas till trypsin aktiverar också de andra proteolytiska enzymerna, inklusive trypsinogen i sig.
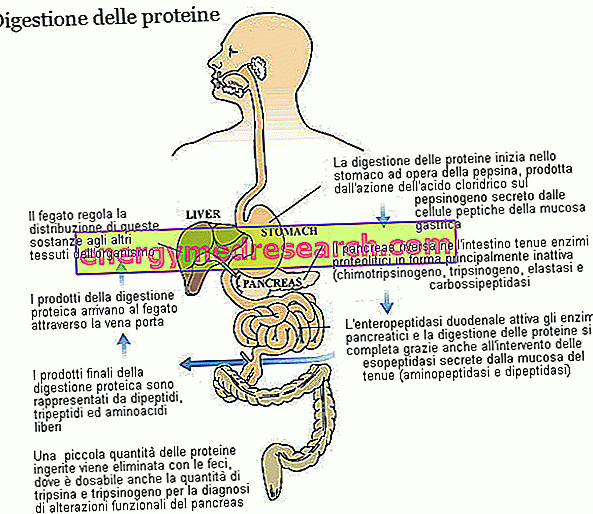
De funktionella skillnaderna mellan trypsin och chymotrypsin avser helt enkelt deras specificitet, det vill säga förmågan att känna igen och bryta ned endast de bindningar som bildas av väldefinierade aminosyror. Trypsin intervenerar huvudsakligen på peptidbindningarna som involverar basiska aminosyror (såsom arginin och lysin), medan chymotrypsin huvudsakligen hydrolyserar bindningar som involverar tyrosin, fenylalanin, tryptofan, leucin och metionin.
Tack vare de olika proteolytiska enzymerna, med bidrag från magsyra, är proteiner av proteiner - ursprungligen bildade av flera tiotals aminosyror - uppdelade i dipeptider, tripeptider och fria aminosyror, alla lätt absorberbara ämnen som kommer från tarmslemhinnans kapillärer transporteras till levern.
Trypsin och chymotrypsin i feces
Bestämningen av chymotrypsin och trypsin i avföring används, och var speciellt så tidigare, som ett indirekt test av den exokrina pankreas funktionella kapacitet. Om något inte fungerar ordentligt på denna körtelnivån är det logiskt att förvänta sig en minskad syntes av trypsin och chymotrypsin, vilket också kommer att vara bristfälligt i avföring. Testet har god känslighet, men belastas av den verkliga risken för falska positiva och falska negativ. Användningen av laxermedel minskar exempelvis koncentrationen av enzymer i fekalmaterialet, medan intaget av mag-pankreatiska extrakt (såsom pankreatin) eller grönsaker (t.ex. ananasstjälk, papaya, papain och bromelain) orsakar falska negativa resultat. Även den intestinala bakteriella floran påverkar lite mängden trypsin och chymotrypsin som kommer oförändrade i avföringen. av denna anledning kan användningen av antibiotika producera falska negativa effekter; Tvärtom, i närvaro av divertikulos och andra tillstånd som gynnar bakteriell proliferation kan falska positiva resultat registreras.
En klassisk tillämpning av trypsin och chymotrypsindosering i avföring är detektering av bukspottkörtelnsufficiens hos patienter med cystisk fibros. En av konsekvenserna av denna sjukdom är försämringen av normal transport av trypsin och andra matsmältningsenzymer från bukspottkörteln till duodenumet. Av denna anledning, vid födseln, är avföring från barnet med cystisk fibros speciellt kompakt, till att orsaka en tarmobstruktion. Som ett resultat registreras särskilt små mängder av chymotrypsin och trypsin i mekonium.



